عفونت پایدار ویروس پاپیلوم انسانی (HPV)

خانواده ویروس پاپیلوم انسانی شامل گروههای مختلفی از ویروسهای DNA قدیمی است. این ویروس در بین طیف وسیعی از گونههای میزبان، از جمله پستانداران، پرندگان، خزندگان و ماهیها شایع است. تاکنون بیش از ۶۵۰ سویه از ویروس پاپیلوم حیوانی و انسانی (HPV) شناسایی شده است و ۴۴۰ سویه از ویروس HPV با هم تکامل پیدا کردهاند تا به بقای خود ادامه داده و در بین انسانها به طور مداوم گسترش پیدا کنند.
سویههای مختلف ویروس HPV بر اساس هومولوژی توالی DNA در ژن L1 (که پروتئین کپسید ساختاری L1 را تولید میکند) از نظر فیلوژنتیکی به پنج نوع تقسیم میشوند: آلفا، بتا، گاما، مو و نو. ویروسهایی که هرکدام از اینها را تشکیل میدهند تکامل پیدا کردند تا در بدن میزبان خود با بومهای اکولوژیکی متفاوت سازگار شوند.
از بین آنها، سویه آلفای مخاطی (mucosal Alpha) HPV بر اساس توانایی خود در ایجاد سرطان به دو دسته انواع HPV کمخطر (LR-HPVs) یا انواع HPV پرخطر (HR-HPVs) طبقهبندی میشوند.
عفونت HR-HPV عامل تمام موارد سرطان دهانه رحم در زنان میباشد و همچنین با سرطانهای دستگاه تناسلی، مقعد و اوروفارنکس در مردان و زنان ارتباط زیادی دارد.
عفونت آنوژنیتال با HR-HPV انکوژنیک بسیار شایع است و بیشتر این عفونتها از طریق ایمونولوژی کنترل شده و در یک دوره یک تا دوساله از بین میروند.
بهوجودآمدن سرطان ناشی از HPV با عفونت پایدار و طولانیمدت همراه است. بیان مداوم پروتئینهای انکوژن E6 و E7 ویروس، نقاط بازرسی چرخه سلولی را دور میزنند تا توسط سیستم ایمنی مورد شناسایی قرار نگیرند. در نتیجه، سلولهای آلوده بیش از حد تکثیر پیدا میکنند و جهشهای سلولی تجمع یافته باعث شکلگیری سرطانهای مرتبط با HPV میشود.
در این مطالعه، ما عواملی را شرح خواهیم داد که باعث ایجاد عفونت پایدار توسط HR-HPVهای انکوژن میشوند.
سیر طبیعی عفونت HPV
ابتلا به انواع مختلف عفونتهای HPV باعث ایجاد طیفی از نشانههای بالینی و غیربالینی میشود. ممکن است این عفونتها بدون نشانه باشند یا در قالب زگیل خوشخیم یا پاپیلوم روی پوست و اندام تناسلی ظاهر شوند. درحالیکه انواع زیادی از HPV را میتوانیم بخشی از میکروبیوتای بافت سالم در نظر بگیریم، عفونت طولانیمدت توسط HR-HPVs خطر پیشروی انکوژن را افزایش میدهد و امکان دارد منجر به سرطان مهاجم شود. بهاینترتیب، عفونت HR HPV تقریباً عامل ایجاد تمام موارد سرطان دهانه رحم در زنان است و همچنین با سرطانهای دستگاه تناسلی، مقعد و اوروفارنکس در مردان و زنان ارتباط زیادی دارد. علیرغم اینکه در سال ۲۰۰۶ واکسن HPV معرفی شد، نرخ پایین مقبولیت و تردید در دریافت آن منجر به ادامه پیداکردن سرطانهای مرتبط با HPV در مردان و زنان شد؛ بنابراین، عفونت HPV در سالهای آینده نیز دردسرهای بسیار زیادی را ایجاد خواهد کرد.
انواع مختلف HPV در کراتینوسیتهای موجود در بافت پوششی و مخاطی آلوده تکثیر میشوند. درحالیکه بافت سنگفرشی این سطوح نسبت به عفونت آسیبپذیر است، نتیجه عفونت به ویژگیهای سلول آلوده اولیه بستگی دارد. این امر در مورد سرطانهای مرتبط با HPV دهانه رحم، اوروفارنکس و مقعد نیز صدق میکند.
به طور ویژه، سلولهایی که حساسیت بالاتری به عفونت و انکوژنز دارند بیشتر در مناطق ترافیک (TZs) سلولی مستقر هستند. این نقاط به این دلیل احتمال بیشتری برای آلوده شدن دارند که امکان دسترسی به سلولهای بازال پرولیفراتیو در محل اتصال دو نوع سلول اپیتلیال بیشتر است. مطالعات اخیر نشان داد که احتمالاً سلولهای بنیادی در ماندگاری ویروس و انکوژن نقش داشته باشند. همچنین احتمال بیشتری دارد که عفونت سلولهای بنیادی نسبت به سلولهایی که تکثیر گذرا دارند، به عفونتهای طولانیمدت منجر شوند.
بهندرت پیش میآید که عفونت HPV آتورال بیش از دو سال باقی بماند و بیش از ۹۰ درصد عفونتهای قابل تشخیص درمان میشوند و بخشی از عفونتها که غیرقابلتشخیص هستند تا ۵ الی ۷ سال تشخیص داده نمیشوند. درحالیکه پاسخهای ایمنی ذاتی معمولاً میتوانند عفونتهای به وجود آمده را خیلی سریع از بین ببرند، رغبت یک زخم کهنه ناشی از HPV به ازبینرفتن بستگی به یک پاسخ قوی از طرف سلول دارد. بهاینترتیب، عفونت مداوم HPV در افرادی رخ میدهد که قادر نیستند پاسخهای ایمنی ذاتی و انطباقی داشته باشند.
سیر طبیعی عفونت HPV دهانه رحم شامل اکتساب اولیه، تداوم عفونت و در موارد نادرتر، پیشرفت تومور است (شکل ۱). در مراحل اولیه، عفونتها توسط سیستم ایمنی بدن از بین میروند و تومورها تحلیل پیدا میکنند. بااینوجود، هنوز مشخص نیست که آیا همه افراد آلوده به یک نوع HPV آنتیبادی آن را تولید میکنند یا خیر.
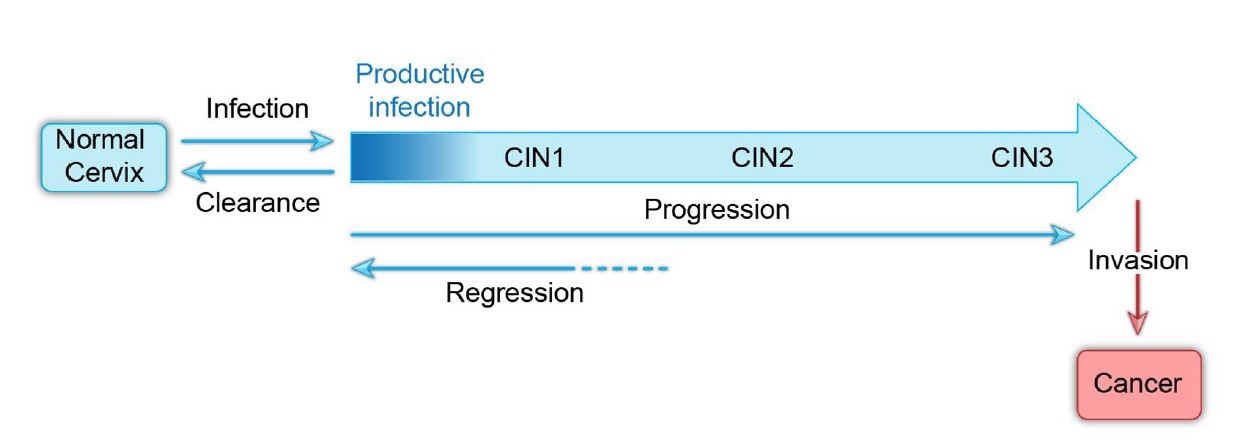
شکل ۱. سیر طبیعی عفونت انکوژنیک ویروس پاپیلومای انسانی. این شکل نشاندهنده پیشروی عفونت HPV به سمت سرطان مهاجم است. عفونت HPV معمولاً توسط سیستم ایمنی طی چند سال برطرف میشود. سلولهای آلوده تحلیل پیدا میکنند، اما همچنین امکان دارد که در طول زمان به سرطان مهاجم تبدیل شوند.
در زنان بروز علائم عفونت HPV در اوایل 20 سالگی به اوج خود میرسد و پس از آن غیرقابلتشخیص میشود. بااینوجود، عفونت تعداد کمی از زنان در میانسالی قابل تشخیص است و هنوز مشخص نیست که این عفونت تازه ایجاد شده یا همان عفونت پنهان مجدداً فعال شده است.
عفونت پنهان HPV در خرگوشهای آزمایشگاهی مشاهده شده است و مناطق کانونی عفونت پنهان در دهانه رحم انسان نیز شناسایی شدهاند؛ بنابراین، HPV پنهان میتواند احتمال تداوم عفونت در بین انسانها را افزایش دهد.
ژنوم HPV
تمام HR-HPVها دارای ژنومهای DNA دو رشتهای و حلقوی کوچکی در حدود ۷ الی ۸ کیلوباز هستند و دو سری از پروتئینهای کلیدی حفاظت شده را رمزگذاری میکنند: پروتئینهایی که برای تکثیر DNA ویروس ضروری هستند (E1 و E2) و پروتئینهای ساختاری که برای تشکیل ویریون، موردنیاز هستند (L1 و L2). علاوه بر این، ژنومهای HR-HPV ژنهای جانبی E4، E5، E6 و E7 را رمزگذاری میکنند که بافت پوششی میزبان را تغییر میدهند تا محیطی مناسب برای تکثیر ویروس ایجاد کنند و ویروس راحتتر بتواند از پاسخ ایمنی ذاتی بدن فرار کند. این ژنها به همراه هم منجر به تداوم ویروس HPV میشوند و از چرخه تولیدمثلی HPV حمایت میکنند.
شمای کلی ژنوم HPV انکوژنیک در شکل ۲ نشان داده شده است.
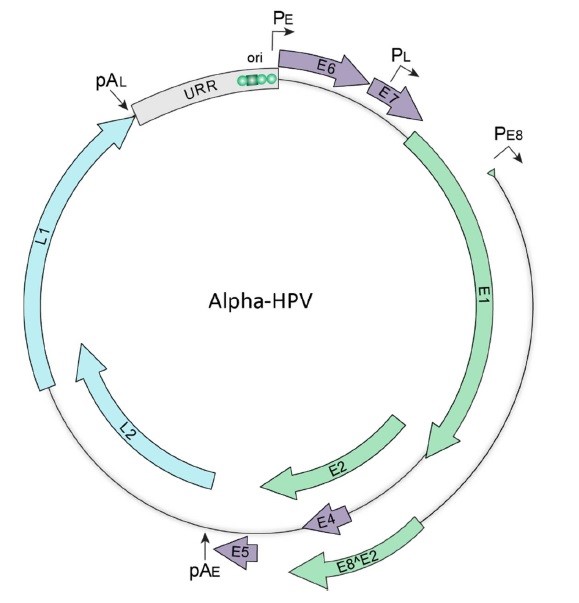
شکل ۲. نقشه ژنوم HPV. نمایش شماتیک ژنوم سویه آلفا ویروس پاپیلوما. فلشهای سبز، بنفش و آبی به ترتیب نشاندهنده چارچوب خوانش باز اولیه، میانی و تأخیری ویروس است. ناحیه تنظیمکننده بالادست (URR) با رنگ خاکستری نشاندادهشده است که جایگاه شروع همانندسازی (ori) در آن قرار دارند و آن نیز حاوی سایتهای اتصال برای همانندسازی E1 و E2 است (به ترتیب با مربع و دایره سبز مشخص شده است). پروموتورهای ابتدایی (PE)، تأخیری (PL) و E8 (PE8) و سایتهای پلیآدنیله اولیه (pAE) و تأخیری (pAL) نیز در شکل نشاندادهشده است.
ژنوم HPV به سه ناحیه تقسیم شده است: دو ناحیه پروتئینهای ویروس را تولید میکنند و یک ناحیه رونویسی و تکثیر ویروس را انجام میدهد.
مناطق کدکننده ژنوم ویروس شامل هفت تا نه چارچوب خوانش باز است که به نواحی ابتدایی و تأخیری تقسیم شدهاند. ناحیه ابتدایی پروتئینهای E1، E2، E1^E4، E8^E2، E5، E6، و E7 را کد میکند و منطقه تأخیری پروتئینهای کپسید L1 و L2 را کد میکند. منطقه غیرکدکننده، که به عنوان ناحیه تنظیم کننده بالادست (URR) نیز شناخته میشود، در بالای ناحیه ابتدایی قرار دارد و شامل چندین عنصر تنظیم کننده سیس مورد نیاز برای رونویسی و همانندسازی است.
رونویسی از ژنوم ویروس در سه فاز (ابتدایی، میانی و تأخیری) انجام میشود و ارتباط تنگاتنگی با برنامه تمایز سلولهای اپیتلیال میزبان دارد. رونویسی فاز ابتدایی ژن ویروسی از پروموتور ابتدایی PE در کراتینوسیتهای بنیادین تمایز نیافته آغاز میشود و به سایت پلیآدنیله pAE ناحیه ابتدایی ختم میشود. در سلولهای سوپرا بازال، رونویسی میانی از پروموتور تأخیری PL آغاز شده و در سایت پلیآدنیله اولیه پایان مییابد. این رونویسی منجر به افزایش میزان نسخهبرداری پروتئینهای E1 و E2 میشود که برای تکثیر DNA ضروری هستند. در نهایت، رونویسی تأخیری ویروس از پروموتور تأخیری PL آغاز شده و در سایت پلیآدنیله تأخیری pAL تمام میشود که منجر به بیان پروتئینهای کپسید ساختاری L1 و L2 میشود.
مروری بر چرخه حیات HPV
چرخه حیات HPV از برنامه تمایز بافت پوششی و مخاطی میزبان برای ایجاد عفونت استفاده میکند. شمای چرخه عفونت HPV و الگوی بیان ژن این ویروس در شکل ۳ نمایشدادهشده است. برای شروع عفونت، ذره ویروسی HPV ابتدا باید از طریق خراش (میکروابریژن) یا زخم در بافت چندلایه پوششی به سلولهای در حال تقسیم ” بازال“ در لایه زیرین بافت پوششی (اپیتلیال) دسترسی پیدا کند. اتصال ذره ویروسی به پروتئوگلیکانهای هپاران سولفات در غشای پایه و به دنبال آن انتقال به یک گیرنده ثانویه بدونمشخصه بر روی کراتینوسیتها باعث ایجاد یک سری تغییرات ساختاری میشود که منجر بهسهولت ورود ویروس به بدن میشود.
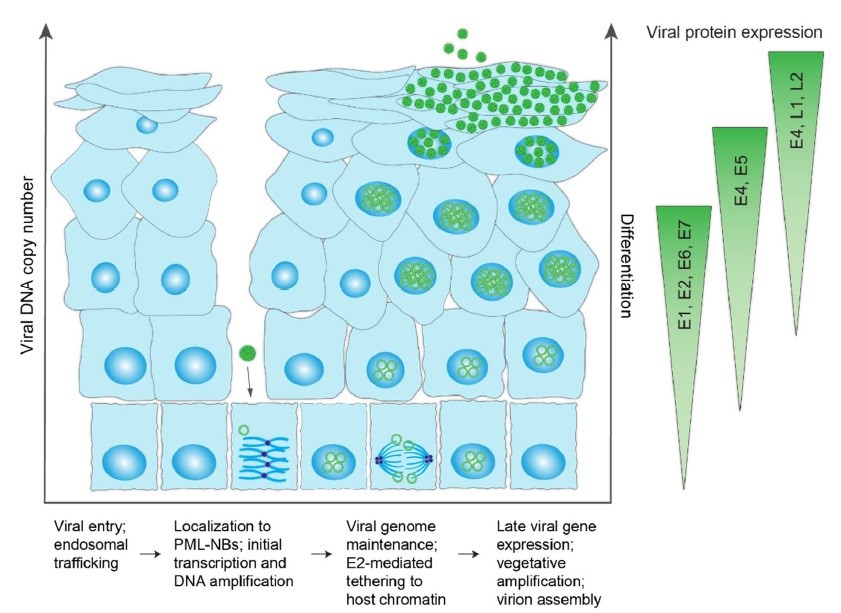
شکل ۳. چرخه حیات عفونی .HPV نمایش شماتیک لایههای تمایزیافته یک اپیتلیوم چندلایه که به HPV آلوده شده است. این ویروس از طریق میکروابریژن به کراتینوسیتهای بنیادی دسترسی پیدا میکند. بهمحض ورود به سلول، انتقال ویروس از طریق آندوزوم انجام میشود و به دنبال ازبینرفتن غشای هسته در طی تقسیم میتوز، وارد هسته (که در یک وزیکول غشایی قرار گرفته است) میشود. در داخل هسته، ژنومهای HPV که در لوسمی پرومیلوسیتیک هستهای (PML-NBs) جمع میشوند، دستخوش دور محدودی از سنتز DNA قرار میگیرند و به کروماتین میزبان متصل میشوند تا در سلول در حال تقسیم کپیهای ثابتی از ژنوم ویروس تشکیل شود. پس از تمایز سلولهای اپیتلیال، سلولهای آلوده کپیهای زیادی از DNA ویروس به وجود میآورند و ژنهای تأخیری ویروس برای مونتاژ یا بستهبندی ویریون بیان میشوند. ویریونها از طریق اسکواموسهای ویروسی از سطح بافت پوششی جدا میشوند. مراحل مختلف چرخه حیات ویروس در پایین تصویر شماتیک و سطوح بیان پروتئین ویروس متناظر با آن در سمت راست نشاندادهشده است.
ذره HPV از طریق اندوسیتوز وارد سلولهای کراتینوسیت بنیادین میشود که در طی آن پروتئین L2 وارد غشاء میشود و ویروس را در یک وزیکول غشایی میپوشاند. L2 با عوامل جابهجایی سلولی داخل سیتوپلاسم ارتباط برقرار میکند تا انتقال HPV به دستگاه گلژی ترانس (جایی که وزیکول حاوی HPV تا زمان دسترسی به هسته میزبان در آن باقی میماند) راحتتر صورت گیرد. به دنبال شکسته شدن پوشش هسته در طول میتوز، وزیکول وارد هسته میشود و از طریق L2 به کروموزومهای میتوزی متراکم متصل میشود. یک ناحیه مرکزی در پروتئین کپسید کوچک L2 اتصال ژنوم ویروسی را راحتتر میکند. وزیکول حامل HPV تا پایان تقسیم میتوز و بازسازی پوشش هسته همراه کروموزومهای میزبان باقی میماند.
پس از شکلگیری هستهها، DNA ویروس در اجسام لوسمی پرومیلوسیتیک هستهای (PML-NBs) متمرکز میشود و این احتمال وجود دارد که رونویسی و همانندسازی DNA ویروس در آنجا آغاز شود. علیرغم نقش PML-NBs میزبان در محدودکردن بیان ژن اکثر ویروسهای DNA، رونویسی کارآمد ژنوم HPV به PML-NBs و جابهجایی پروتئین ساکن PML-NB Sp100 بستگی دارد. بهاینترتیب، HPV از برخی اجزاء NBs PML استفاده میکند و از برخی دیگر برای اطمینان از گسترش موفقیتآمیز عفونت دوری میکند.
ژنوم HPV از سه فاز همانندسازی DNA ویروسی استفاده میکند: تکثیر اولیه (initial amplification)، تکثیر نگهدارنده (maintenance) و تکثیر رویشی (vegetative amplification). در طول تکثیر اولیه، ژنوم ویروسی چند دور همانندسازی DNA را انجام میدهد تا تعداد کمی از ژنومهای خارج کروموزومی ایجاد شود که در سلولهای خود تجدیدشونده بازال در بافت اپیتلیوم زیرین باقی میمانند.
این مجموعه از سلولهای بازال عفونی بهعنوان مخزنی برای عفونت پایدار HPV عمل میکند. تکثیر نگهدارنده در سلولهای در حال تکثیر انجام میشود و در آنجا ژنومهای ویروسی خارج کروموزومی به همراه DNA سلولی میزبان تکثیر میشوند و به کروماتین میزبان متصل میشوند تا اطمینان حاصل شود که از سلولهای مادر به سلولهای دختر میروند.
تعداد نسخههای ویروسی در یک عدد ثابت نگهداشته میشود تا زمانی که سلولها شروع به تمایز و حرکت به سمت سطح اپیتلیوم کنند، در این نقطه بیان تأخیری ژن ویروس صورت میگیرد و DNA به میزان زیادی تکثیر مییابد (شکل ۴).
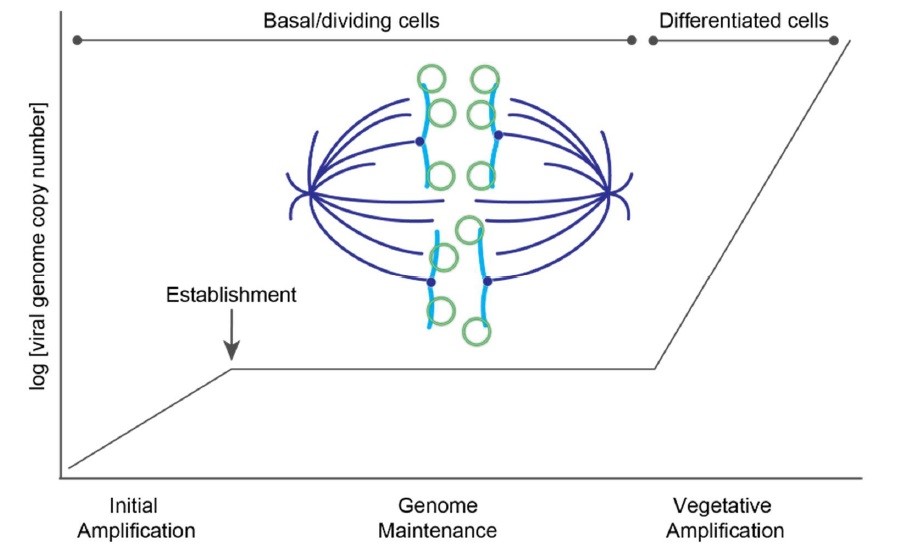
شکل ۴: فازهای همانندسازی HPV. این نما فازهای مختلف همانندسازی HPV در اپیتلیوم میزبان را نشان میدهد. بهمحض ورود، ژنومهای HPV دستخوش تکثیر موضعی DNA به تعداد زیاد میشود. ژنوم ویروس در هسته تثبیت میشود و در فاز نگهداری به تعداد کم همانندسازی میکند و به سلولهای دختر میرود. در سلولهای تمایزیافته، DNA ویروسی دستخوش دومین تکثیر ناگهانی میشود و تعداد زیادی ژنوم برای ویرونها ایجاد میکند ... مدلی که نحوه تقسیم ژنوم ویروسی در فاز نگهداری نشان میدهد نیز به تصویر کشیده شده است. ژنومهای HPV (دایرههای سبز) به سلولهای میزبان (آبی) متصل میشوند و به در طی میوز به سلولهای دختر میروند. دوک میتوزی با رنگ آبی تیره نشاندادهشده است.





